Alcoholes, Acetonas, Aldheidos y Eteres
ALCOHOLES
PROPIEDADES
DE LOS ALCOHOLES
Los alcoholes son compuestos que presentan en la cadena
carbonada uno o más grupos hidroxi u oxidrilo (-OH).
Propiedades Físicas:
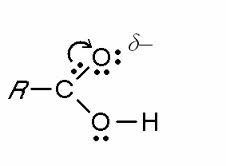
El grupo –OH es muy polar y, lo que es más importante,
es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con
otras moléculas neutras.
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
alcohol-alcohol
alcohol-agua A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
1 propanol
Hexanol
Punto de Ebullición:
Los puntos de ebullición de los alcoholes también son
influenciados por la polaridad del compuesto y la cantidad de puentes de
hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de
ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular.
En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de
carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la
cantidad de carbonos.
Densidad: La densidad de los
alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los
alcoholes alifáticos son menos densos que el agua mientras que los alcoholes
aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles,
son más densos.
(Constantes Físicas de algunos
alcoholes)
Nombre Punto de fusiónºC Punto de ebullición ºC
Densidad Metanol -97,5 64,5 0,793
1-propanol -126 97,8 0,804
2-propanol -86 82,3 0,789
1-butanol -90 117 0,810
2-butanol -114 99,5 0,806
2-metil-1-propanol -108 107,3 0,802
2-metil-2-propanol 25,5 82,8 0,789
1-pentanol -78,5 138 0,817
Ciclohexanol 24 161,5 0,962
Propiedades Químicas:
La estructura del alcohol está relacionada con su
acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el
cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que
presentan dos o más moléculas de carbono.
Alcohol Terciario
2-metil-2-propanol
Alcohol Secundario 2-butanol
Alcohol Primario 1-butanol
Metanol
Metanol > alcohol primario > alcohol secundario > alcohol terciario(>: mayor acidez)
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
Deshidratación: la deshidratación de los alcoholes se considera una reacción de eliminación, donde el alcohol pierde su grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor.
La
deshidratación es posible ya que el alcohol acepta un protón del ácido, para
formar el alcohol protonado o ión alquil hidronio.
El alcohol protonado pierde una molécula de agua y forma un ión alquil-carbonio:
El ión alquil-carbonio pierde un protón lo que regenera la molécula de ácido sulfúrico y se establece el doble enlace de la molécula a la cual está dando origen el alcohol.
El calentamiento de un alcohol en presencia de ácido sulfúrico a temperaturas inferiores a las necesarias para obtener alquenos producirá otros compuestos como éteres y ésteres.
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm
¿COMO SE FORMAN LOS ALCOHOLES?
Los principales métodos de obtención de alcoholes son:
a) Hidratación de alquenos
Se trata de una reacción de adición electrófila, que esquemáticamente puede representarse mediante la ecuación:
R—CH=CH2 + H2O
H2SO4
R—CHOH—CH3
El grupo - OH se adiciona al átomo de carbono más sustituido del doble enlace. Por ello, éste es un método muy apropiado para la obtención de alcoholes secundarios y terciarios, algunos de los cuales se preparan así industrialmente a partir de las fracciones de olefinas procedentes del craqueo del petróleo. Asimismo, éste es el método industrial más importante de fabricación de alcohol etílico, por hidratación del etileno, CH2 = CH2 en presencia de ácido sulfúrico.
b) Hidrólisis de halogenuros de alquilo
Se lleva a cabo normalmente en disolución de etanol acuoso y en presencia de catalizadores básicos, como KOH, AgOH, CO3Ca, etc.
R—CH2—Cl + AgOH
AgCl + R—CH2OH
c) Reducción de compuestos carbonílicos
Esta reacción puede realizarse industrialmente con hidrógeno, en presencia de catalizadores, o bien en el laboratorio, mediante el hidruro de litio y aluminio, H4LiAl. Con aldehídos se obtienen alcoholes primarios y con cetonas alcoholes secundarios, según las siguientes ecuaciones:
d) Mediante reactivos de Grignard
La adición de un magnesiano o reactivo de Grignard a un compuesto carbonílico da lugar a un halogenuro de alcoximagnesio, que por hidrólisis conduce a un alcohol. Cuando se emplea formaldehído, H2C=O, como producto de partida, se obtiene un alcohol primario; con los restantes aldehídos se obtienen alcoholes secundarios y con las cetonas alcoholes terciarios.
) Métodos especiales
Los dos primeros miembros de la serie de alcoholes alifáticos, metanol y etanol, se obtienen también por métodos especiales que conviene mencionar. El metanol se obtenía antiguamente por destilación seca de la madera, de donde procede el nombre de alcohol de madera con que a veces se le conoce. Modernamente, casi todo el metanol que se consume en la industria se obtiene por hidrogenación catalítica del monóxido de carbono, según la reacción:
CO + 2H2 CH3OH
Que se lleva a cabo a unos 400 °C y 200 atm, en presencia de catalizadores formados corrientemente por una mezcla de óxidos de cromo y de cinc. El alcohol metílico es muy venenoso. Por ello, el consumo humano de alcohol etílico para usos industriales, que está desnaturalizado con metanol produce graves lesiones en la vista, ceguera e incluso la muerte.
El etanol (alcohol del vino) se ha venido produciendo desde la antigüedad por fermentación de los azúcares (como glucosa), contenidos en jugos de frutos, para la fabricación de bebidas alcohólicas. La fermentación se produce por la acción de enzimas (o fermentos), que son catalizadores orgánicos complejos segregados por las células de levaduras, obteniéndose, como productos finales, etanol y CO2, según la reacción global:
C 6H12 06
2CO2 + 2CH3—CH2 OH
Glucosa
Etanol
Además de la glucosa pueden también fermentar por la acción de levaduras otros azúcares más complejos y el almidón, contenido en la patata y cereales, que primero se desdoblan en azúcares simples, antes de la fermentación alcohólica propiamente dicha. Una concentración elevada de alcohol impide el proceso de fermentación, por lo que sólo pueden obtenerse concentraciones del 10 al 18 % en etanol, que son típicas de los vinos naturales. Por destilación fraccionada puede lograrse aumentar la riqueza en etanol hasta el 95 %, con 5% de agua, que es la composición que circula en el comercio y se vende en las farmacias como alcohol «puro».
FUNCIONES
EN EL ORGANISMO
El proceso de la descomposición del alcohol en el organismo y como reacciona en el metabolismo, te escribo las reacciones de descomposición del ALCOHOL ETILICO dentro de nuestro cuerpo, POR OXIDACION DEL ETANOL TENEMOS:
Alcohol Etilico + Dioxigeno...........Acetaldehido...+ Agua
CH3-CH2-OH + 1/2 O2 -----------------> CH3-CH=O + H2O
Es decir, que lo primero que produce nuestro cuerpo es ACETALDEHIDO, la oxidación del etanol en el metabolismo del cuerpo humano se considera como principal factor para la aparición de la resaca tras la ingesta de bebidas alcohólicas, también produce varios efectos al cuerpo que hace que el cuerpo intente eliminarlo del cuerpo, mediante la piel, mediante el aliento, y la parte que procesa el hígado, la trata de eliminar lo más pronto posible, transformándolo en grasa en la parte abdominal del cuerpo, la cual provoca lo que se conoce como "barriga de cervecero".
La segunda Reacción, es la descomposicion del ACETALDEHIDO a ACIDO ACETICO
Acetaldehido + Oxígeno...................Acido Acetico + Agua
CH3-CH=O + O2 -----------------------> CH3-OH.C=O + H2O
BALANCEADA
2 CH3-CH=O + 2 O2 -----------> 2 CH3-OH.C=O + O2
Este es el que provoca dolor de garganta, vómito, diarrea, dolor abdominal, sensación de quemazón en el tracto digestivo, etc
4. La Tercera y ultima REACCION es la Descomposicion del ACIDO ACETICO EN CO2 Y H20
Acido Acetico + Oxígeno..............Dióxido de carbono + Agua
CH3-OH.C=O + 2 O2 ---------------------> 2 CO2 + 2H2O
BALANCEADA
CH3-OH.C=O + 2 O2 ---------------------> 2 CO2 + 2H2O
https://www.google.com.mx/search?hl=es&sclient=psy-ab&q=propiedades+quimicas+y+fisicas+de+las+ancinas&oq=propiedades+quimicas+y+fisicas+de+las+ancinas&aq=f&aqi=&aql=&gs_l=serp.3...3326l4079l0l4305l3l3l0l0l0l0l0l0ll0l0.frgbld.&pbx=1&biw=_
http:=funciones+en+el++organismo+de+los+alcholes+quimica&oq=funciones+en+el++organismo+de+los+alcholes+quimica&
NOMBRES
DE ALCOHOLES
MetanolPor destilación destructiva de la madera. También por reacción entre el hidrógeno y el monóxido de carbono a alta presión.
Disolvente para grasas, aceites, resinas y nitrocelulosa. Fabricación de tinturas, formaldehído, líquidos anticongelantes, combustibles especiales y plásticos.
Etanol
Por fermentación de azúcares. También a partir de etileno o de acetileno. En pequeñas cantidades, a partir de la pulpa de madera.
Disolvente de productos como lacas, pinturas, barnices, colas, fármacos y explosivos. También como base para la elaboración de productos químicos de elevada masa molecular.
2-propanol
(isopropanol)
Por hidratación de propeno obtenido de gases craqueados. También subproducto de determinados procesos de fermentación.
Disolvente para aceites, gomas, alcaloides y resinas. Elaboración de acetona, jabón y soluciones antisépticas.
1-propanol
(n-propanol)
Por oxidación de mezclas de propano y butano.
Disolvente para lacas, resinas, revestimientos y ceras. También para la fabricación de líquido de frenos, ácido propiónico y plastificadores.
Butanol
(n-butanol)
Por fermentación de almidón o azúcar. También por síntesis, utilizando etanol o acetileno.
Disolvente para nitrocelulosa, etilcelulosa, lacas, plásticos de urea-formaldehído y urea-melamina. Diluyente de líquido hidráulico, agente de extracción de drogas.
Metilpropanol
Por reacción entre el hidrógeno y el monóxido de carbono a alta presión, seguida de destilación de los productos obtenidos.
Disolvente de líquidos de freno elaborados con aceite de ricino. Sustituto de n-butanol en la elaboración de resinas de urea.
2-butanol
Por hidrólisis del butano, formado por craqueo de petróleo.
En la elaboración de otros productos químicos, por ejemplo metiletilcetona. Disolvente de lacas de nitrocelulosa. Producción de líquido de frenos y grasas especiales.
Metil-2-propanol
Por hidratación de isobutileno, derivado del craqueo de petróleo.
En perfumería. Como agente humedecedor en detergentes. Disolvente de fármacos y sustancias de limpieza.
Pentanol
(alcohol amílico)
Por destilación fraccional de aceite de fusel, un producto secundario en la elaboración del etanol por fermentación.
Disolvente de numerosas resinas naturales y sintéticas. Diluyente de líquido para frenos, tintas de imprenta y lacas. En fármacos.
Etilenglicol
Por oxidación de etileno a glicol. También por hidrogenación de metilglicolato obtenido a partir del formaldehído y el metanol.
Líquido anticongelante, líquido para frenos. En la producción de explosivos. Disolvente de manchas, aceites, resinas, esmaltes, tintas y tinturas.
Dietilenglicol
Como subproducto en la fabricación de etilenglicol.
Disolvente de tinturas y resinas. En el secado de gases. Agente reblandecedor de tintas de imprenta adhesivas.
Glicerina
(1,2,3-propanotriol)
Del tratamiento de grasas en la elaboración del jabón. Sintéticamente, a partir del propeno. Por fermentación de azúcares.
En resinas alquídicas, explosivos y celofán. Humectante de tabaco.
Pentaeritritol
(pentaeritrita)
Por condensación de acetaldehído y formaldehído.
En resinas sintéticas. Como tetranitrato en explosivos. TambiÈn en el tratamiento farmacológico de enfermedades cardiacas.
Sorbitol
Por reducción de azúcar con hidrógeno.
En la elaboración de alimentos, fármacos y productos químicos. Acondicionador de papel, textiles, colas y cosméticos. Fuente de alcohol en la fabricación de resinas.
Ciclohexanol
Por hidrogenación catalítica del fenol. Por oxidación catalítica del ciclohexano.
Producto intermedio en la fabricación de sustancias químicas utilizadas en la fabricación del nailon. Estabilizador y homogeneizador de jabones y detergentes sintÈticos. Disolvente.
UTILIZACIÓN DE LOS ALCOHOLES EN LA VIDA DIARIA.
Por hidratación de isobutileno, derivado del craqueo de petróleo.
En perfumería. Como agente humedecedor en detergentes. Disolvente de fármacos y sustancias de limpieza.
Pentanol
(alcohol amílico)
Por destilación fraccional de aceite de fusel, un producto secundario en la elaboración del etanol por fermentación.
Disolvente de numerosas resinas naturales y sintéticas. Diluyente de líquido para frenos, tintas de imprenta y lacas. En fármacos.
Etilenglicol
Por oxidación de etileno a glicol. También por hidrogenación de metilglicolato obtenido a partir del formaldehído y el metanol.
Líquido anticongelante, líquido para frenos. En la producción de explosivos. Disolvente de manchas, aceites, resinas, esmaltes, tintas y tinturas.
Dietilenglicol
Como subproducto en la fabricación de etilenglicol.
Disolvente de tinturas y resinas. En el secado de gases. Agente reblandecedor de tintas de imprenta adhesivas.
Glicerina
(1,2,3-propanotriol)
Del tratamiento de grasas en la elaboración del jabón. Sintéticamente, a partir del propeno. Por fermentación de azúcares.
En resinas alquídicas, explosivos y celofán. Humectante de tabaco.
Pentaeritritol
(pentaeritrita)
Por condensación de acetaldehído y formaldehído.
En resinas sintéticas. Como tetranitrato en explosivos. TambiÈn en el tratamiento farmacológico de enfermedades cardiacas.
Sorbitol
Por reducción de azúcar con hidrógeno.
En la elaboración de alimentos, fármacos y productos químicos. Acondicionador de papel, textiles, colas y cosméticos. Fuente de alcohol en la fabricación de resinas.
Ciclohexanol
Por hidrogenación catalítica del fenol. Por oxidación catalítica del ciclohexano.
Producto intermedio en la fabricación de sustancias químicas utilizadas en la fabricación del nailon. Estabilizador y homogeneizador de jabones y detergentes sintÈticos. Disolvente.
UTILIZACIÓN DE LOS ALCOHOLES EN LA VIDA DIARIA.
METANOL
El alcohol de madera, alcohol metílico o metanol, de fórmula CH3OH, es el más simple de los alcoholes. Antes se preparaba por destilación destructiva de la madera, pero hoy en día casi todo el metanol producido es de origen sintético, elaborado a partir de hidrógeno y monóxido de carbono. El metanol se utiliza para desnaturalizar alcohol etílico, como anticongelante, disolvente para gomas y lacas, así como en la síntesis de compuestos orgánicos como el metanal (formaldehído). Al ser ingerido en forma líquida o inhalado en vapor, el metanol puede resultar peligroso. Tiene un punto de fusión de
-97,8 °C y un punto de ebullición de 64,7 °C. Su densidad relativa es de 0,7915 a 20 °C.
ETANOL
El alcohol de vino, alcohol etílico o etanol, de fórmula C2H5OH, es un líquido transparente e incoloro, con sabor a quemado y un olor agradable característico. Es el alcohol que se encuentra en bebidas como la cerveza, el vino y el brandy. Debido a su bajo punto de congelación, ha sido empleado como fluido en termómetros para medir temperaturas inferiores al punto de congelación del mercurio, -40°C, y como anticongelante en radiadores de automóviles.
Normalmente el etanol se concentra por destilación de disoluciones diluidas. El de uso comercial contiene un 95% en volumen de etanol y un 5% de agua. Ciertos agentes deshidratantes extraen el agua residual y producen etanol absoluto. El etanol tiene un punto de fusión de -114,1 °C, un punto de ebullición de 78,5 °C y una densidad relativa de 0,789 a 20 °C.
Desde la antigüedad, el etanol se ha obtenido por fermentación de azúcares. Todas las bebidas con etanol y casi la mitad del etanol industrial aún se fabrican mediante este proceso. El almidón de la patata (papa), del maíz y de otros cereales constituye una excelente materia prima. La enzima de la levadura, la cimasa, transforma el azúcar simple en dióxido de carbono. La reacción de la fermentación, representada por la ecuación
C6H12O6 ! 2C2 H5OH + 2CO2
Es realmente compleja, ya que los cultivos impuros de levaduras producen una amplia gama de otras sustancias, como el aceite de fusel, la glicerina y diversos ácidos orgánicos. El líquido fermentado, que contiene de un 7 a un 12% de etanol, se concentra hasta llegar a un 95% mediante una serie de destilaciones. En la elaboración de ciertas bebidas como el whisky y el brandy, algunas de sus impurezas son las encargadas de darle su característico sabor final. La mayoría del etanol no destinado al consumo humano se prepara sintéticamente, tanto a partir del etanal (acetaldehído) procedente del etino (acetileno), como del eteno del petróleo. También se elabora en pequeñas cantidades a partir de la pulpa de madera.La oxidación del etanol produce etanal que a su vez se oxida a ácido etanoico. Al deshidratarse, el etanol forma dietiléter. El butadieno, utilizado en la fabricación de caucho sintético, y el cloroetano, un anestésico local, son otros de los numerosos productos químicos que se obtienen del etanol. Este alcohol es miscible (mezclable) con agua y con la mayor parte de los disolventes orgánicos. Es un disolvente eficaz de un gran número de sustancias, y se utiliza en la elaboración de perfumes, lacas, celuloides y explosivos. Las disoluciones alcohólicas de sustancias no volátiles se denominan tinturas. Si la disolución es volátil recibe el nombre de espíritu.
El alcohol de madera, alcohol metílico o metanol, de fórmula CH3OH, es el más simple de los alcoholes. Antes se preparaba por destilación destructiva de la madera, pero hoy en día casi todo el metanol producido es de origen sintético, elaborado a partir de hidrógeno y monóxido de carbono. El metanol se utiliza para desnaturalizar alcohol etílico, como anticongelante, disolvente para gomas y lacas, así como en la síntesis de compuestos orgánicos como el metanal (formaldehído). Al ser ingerido en forma líquida o inhalado en vapor, el metanol puede resultar peligroso. Tiene un punto de fusión de
-97,8 °C y un punto de ebullición de 64,7 °C. Su densidad relativa es de 0,7915 a 20 °C.
ETANOL
El alcohol de vino, alcohol etílico o etanol, de fórmula C2H5OH, es un líquido transparente e incoloro, con sabor a quemado y un olor agradable característico. Es el alcohol que se encuentra en bebidas como la cerveza, el vino y el brandy. Debido a su bajo punto de congelación, ha sido empleado como fluido en termómetros para medir temperaturas inferiores al punto de congelación del mercurio, -40°C, y como anticongelante en radiadores de automóviles.
Normalmente el etanol se concentra por destilación de disoluciones diluidas. El de uso comercial contiene un 95% en volumen de etanol y un 5% de agua. Ciertos agentes deshidratantes extraen el agua residual y producen etanol absoluto. El etanol tiene un punto de fusión de -114,1 °C, un punto de ebullición de 78,5 °C y una densidad relativa de 0,789 a 20 °C.
Desde la antigüedad, el etanol se ha obtenido por fermentación de azúcares. Todas las bebidas con etanol y casi la mitad del etanol industrial aún se fabrican mediante este proceso. El almidón de la patata (papa), del maíz y de otros cereales constituye una excelente materia prima. La enzima de la levadura, la cimasa, transforma el azúcar simple en dióxido de carbono. La reacción de la fermentación, representada por la ecuación
C6H12O6 ! 2C2 H5OH + 2CO2
Es realmente compleja, ya que los cultivos impuros de levaduras producen una amplia gama de otras sustancias, como el aceite de fusel, la glicerina y diversos ácidos orgánicos. El líquido fermentado, que contiene de un 7 a un 12% de etanol, se concentra hasta llegar a un 95% mediante una serie de destilaciones. En la elaboración de ciertas bebidas como el whisky y el brandy, algunas de sus impurezas son las encargadas de darle su característico sabor final. La mayoría del etanol no destinado al consumo humano se prepara sintéticamente, tanto a partir del etanal (acetaldehído) procedente del etino (acetileno), como del eteno del petróleo. También se elabora en pequeñas cantidades a partir de la pulpa de madera.La oxidación del etanol produce etanal que a su vez se oxida a ácido etanoico. Al deshidratarse, el etanol forma dietiléter. El butadieno, utilizado en la fabricación de caucho sintético, y el cloroetano, un anestésico local, son otros de los numerosos productos químicos que se obtienen del etanol. Este alcohol es miscible (mezclable) con agua y con la mayor parte de los disolventes orgánicos. Es un disolvente eficaz de un gran número de sustancias, y se utiliza en la elaboración de perfumes, lacas, celuloides y explosivos. Las disoluciones alcohólicas de sustancias no volátiles se denominan tinturas. Si la disolución es volátil recibe el nombre de espíritu.
ALCOHOLES SUPERIORES
Los alcoholes superiores, de mayor masa molecular que el etanol, tienen diversas aplicaciones tanto específicas como generales: el propanol se usa como alcohol para frotar y el butanol como base para perfumes y fijadores. Otros constituyen importantes condimentos y perfumes.
Metanol
En la antigüedad el Metanol se obtenía por destilación seca de la madera. Actualmente se prepara en grandes cantidades por catalítica del monóxido de carbono:
Co + H2 H-CH2-OH
) El Metanol no se utiliza en bebidas Alcohólicas, debido a su poder de Toxicidad.
El Alcohol Etílico es el apropiado para la fabricación de bebidas alcohólicas., Con el fin de que no sirva para la preparación de bebidas.
Se prepara industrialmente por diversos métodos:
a) Partiendo del etileno (del craqueo del petróleo) por vapor a presión, en presencia de un catalizador:
C2H4 + H2O C2H5-OH
b) A Partir del Acetileno, por hidratación en presencia de sales mercúricas, dando un aldehído posteriormente se reduce por el hidrógeno, en presencia de níquel finamente dividido que actúa como catalizador.
c) Se obtiene en grandes cantidades por fermentación de líquidos azucarados. Su obtención se basa en que la glucosa (un azúcar de formula: C6H12O6) fermenta por la acción de un enzima producido por un grupo de hongos microscópicos, sacaromicetos (levadura de cerveza), dando alcohol y anhídrido Carbónico.
Para la obtención industrial del alcohol seria demasiado cara la glucosa como materia prima. Por esto se parte de las mezclas del azúcar de caña o de remolacha o de otros materiales ricos en almidón, papas o semillas de gramíneas.
d) El almidón se transforma por la acción de una enzima en maltosa, que a su vez por otra acción enzimática, se desdobla en dos moléculas de glucosa.
ð El metanol es tóxico tanto como líquido o como vapor. Puede ingresar al organismo por la nariz, la boca o la piel (especialmente por vía de cortes o lastimaduras) y es rápidamente absorbido por los fluidos del cuerpo.
Los alcoholes superiores, de mayor masa molecular que el etanol, tienen diversas aplicaciones tanto específicas como generales: el propanol se usa como alcohol para frotar y el butanol como base para perfumes y fijadores. Otros constituyen importantes condimentos y perfumes.
Metanol
En la antigüedad el Metanol se obtenía por destilación seca de la madera. Actualmente se prepara en grandes cantidades por catalítica del monóxido de carbono:
Co + H2 H-CH2-OH
) El Metanol no se utiliza en bebidas Alcohólicas, debido a su poder de Toxicidad.
El Alcohol Etílico es el apropiado para la fabricación de bebidas alcohólicas., Con el fin de que no sirva para la preparación de bebidas.
Se prepara industrialmente por diversos métodos:
a) Partiendo del etileno (del craqueo del petróleo) por vapor a presión, en presencia de un catalizador:
C2H4 + H2O C2H5-OH
b) A Partir del Acetileno, por hidratación en presencia de sales mercúricas, dando un aldehído posteriormente se reduce por el hidrógeno, en presencia de níquel finamente dividido que actúa como catalizador.
c) Se obtiene en grandes cantidades por fermentación de líquidos azucarados. Su obtención se basa en que la glucosa (un azúcar de formula: C6H12O6) fermenta por la acción de un enzima producido por un grupo de hongos microscópicos, sacaromicetos (levadura de cerveza), dando alcohol y anhídrido Carbónico.
Para la obtención industrial del alcohol seria demasiado cara la glucosa como materia prima. Por esto se parte de las mezclas del azúcar de caña o de remolacha o de otros materiales ricos en almidón, papas o semillas de gramíneas.
d) El almidón se transforma por la acción de una enzima en maltosa, que a su vez por otra acción enzimática, se desdobla en dos moléculas de glucosa.
ð El metanol es tóxico tanto como líquido o como vapor. Puede ingresar al organismo por la nariz, la boca o la piel (especialmente por vía de cortes o lastimaduras) y es rápidamente absorbido por los fluidos del cuerpo.
AFECTACIÓN EN EL ORGANISMO DEL EXESO Y LA CARENCIA
DE
ESTE COMPUETO
El etanol es una sustancia que se puede administrar de
diversas formas y absorber por múltiples vías. Como sustancia psicoactiva, la
principal y casi exclusiva vía de administración es la oral. El proceso de
absorción gastrointestinal se iniciainmediatamente después de su ingestión. La
superficie de mayor absorción es la primera porción del intestino delgado, con
aproximadamente 70 por ciento; en el estómago seabsorbe un 20 por ciento y en el
Colon un 10 por ciento. Su absorción por tractodigestivo se realiza en un
período de dos a seis horas y puede ser modificada por variosfactores como el
vaciamiento gástrico acelerado y la presencia o ausencia de alimentosen el
estómago. El exceso de alcohol ocasiona el desgaste de las reservas de
glicógenoen el hígado y los músculos. La falta de glicógeno disminuye los
azúcares en la sangre y provoca una sensación de debilidad y agotamiento físico.
Al ser insuficiente el trabajorealizado por el hígado el etanol invade el
torrente sanguíneo y se esparce por todos lostejidos del cuerpo.El 98 por ciento
del etanol absorbido realiza su proceso de biotransformación en elhígado, con
una velocidad de 10 ml/hora utilizando para ello tres vías metabólicas:1.Vía de
la enzima alcohol deshidrogenada.2.Vía del sistema microsomal de oxidación
(MEOS).3.Vía de las catalasas.
ALDEHÍDOS
Y CETONAS
PROPIEDADES DE LOS ALDEHÍDOS Y
CETONAS
Los aldehídos y
las cetonas: son compuestos caracterizados por la presencia del grupo carbonilo
(C=O). Los aldehídos presentan el grupo carbonilo en posición terminal mientras
que las cetonas lo presentan en posición intermedia. El primer miembro de la
familia química de los aldehídos es el metanal o formaldehído (aldehído
fórmico), mientras que el primer miembro de la familia de las cetonas es la
propanona o acetona (dimetil acetona)
Metanal
Propanona
Metil-fenil-cetona
Propanona
Las cetonas aromáticas reciben el nombre de felonas.
Propiedades Físicas:
Punto de Ebullición: los puntos de ebullición de los aldehídos y cetonas son mayores que el de los alcanos del mismo peso molecular, pero menores que el de los alcoholes y ácidos carboxílicos comparables. Esto se debe a la formación de dipolos y a la ausencia de formación de puentes de hidrógeno intramoleculares en éstos compuestos.
(Constantes físicas de algunas aldehidos y
cetonas)
Nombre Pto. de fusión(ºC) Pto. de ebullición(ºC) Solubilidad (gr/100 gr de H2O)
Metanal -92 -21 Muy soluble
Etanal -122 20 Soluble al infinito
Propanal -81 49 16
Benzaldehído -26 178 0,3
Propanona -94 56 Soluble al infinito
Butanona -86 80 26
2-pentanona -78 102 6,3
3 pentanona -41 101 5
Acetofenona 21 202 Insoluble
Propiedades Químicas:
Reacciones de adición nucleofílica: Estas reacciones se producen frente al (reactivo de Grignard), para dar origen a un oxihaluro de alquil-magnesio que al ser tratado con agua da origen a un alcohol. El metanal forma alcoholes primarios y los demás aldehídos forman alcoholes secundarios.
La reacción de adición nucleofílica en las cetonas dan
origen a alcoholes terciarios.
Otras reacciones de adición nucleofílica pueden
producirse con el ácido cianhídrico, el sulfito ácido de sodio, la
hidroxilamina, hidracina, semicarbacida, fenilhidracina y con el 2,4
dinitrofenilhidracina, para dar origen a diferentes compuestos químicos.
Los aldehídos y cetonas también pueden dar origen a
otros compuestos mediante reacciones de sustitución halogenada, al reaccionar
con los halógenos sustituyen uno o varios hidrógenos del carbono unido al
carbonilo.Este método permite obtener la monobromoactona que es un poderoso gas
lacrimógeno.
Síntesis y obtención de aldehídos y cetonas
alifáticas:
Los aldehídos y cetonas pueden ser obtenidos mediante
la oxidación de alcoholes.
La hidratación de alquinos en presencia de
ácido sulfúrico en solución acuosa y sulfato mercúrico permite obtener aldehídos
y cetonas.
Síntesis de Aldehídos Aromáticos:
Los aldehídos
aromáticos presentan un anillo aromático unido al grupo carbonilo. El
representante
de este grupo de compuestos es el benzaldehido. La
obtención del benzaldehido puede ser mediante oxidación del tolueno, del cloruro
de bencilo o por hidrólisis del cloruro de bencilideno.
Benzaldehido
Síntesis de cetonas aromáticas
Las cetonas aromáticas (fenonas) presentan uno o dos anillos aromáticos unidos al grupo carbonilo.
Metal-fenil-cetona
difenil-cetona
La mayoría de las cetonas aromáticas se preparan por
acilación de Friedel-Crafts, donde el benceno reacciona con los cloruros de
ácido en presencia de cloruro de aluminio. Así el grupo acilo entra al anillo
para producir las fenonas.
OBTENION DEL LOS ALDEHÍDO Y DE LAS
CETONAS
Los aldehidos y cetonas se producen por la oxidación de alcoholes.
- Los aldehidos se prodecen a partir de la oxidacion de un alcohol primario:
Ej: CH3-CH2OH ....... --[ox]--> ............ CH3-CHO
......... Etanol ........ medio oxidante ........ Etanal
Esta reaccion se la realiza mediante el uso de dicromato de potasio o permanganato de potasio, [ox] seria uno de estos dos compuestos.
Si la oxidacion de un aldehido continua, este se convierte en un ácido carboxílico, en el caso del ejemplo, se convertiria en ácido etanoico (ácido acético)
- Las cetonas se producen a partir de la oxidación de un alcohol secundario:
Ej. CH3-CHOH-CH3 ....... --[ox]--> .............. CH3-CO-CH3
....... 2-propanol .......... medio oxidante ....... 2-propanona
Los alcoholes terciarios no se pueden oxidar en condiciones normales.
USO DE LOS ALDEHÍDOS Y
CETONAS:
Aldehídos:
El metanal o aldehído fórmico es el aldehído con mayor uso en la industria, se utiliza fundamentalmente para la obtención de resinas fenólicas y en la elaboración de explosivos (pentaeritrol y el tetranitrato de pentaeritrol, TNPE) así como en la elaboración de resinas alquídicas y poliuretano expandido.
También se utiliza en la elaboración de uno de los llamados plásticos técnicos que se utilizan fundamentalmente en la sustitución de piezas metálicas en automóviles y maquinaria, así como para cubiertas resistentes a los choques en la manufactura de aparatos eléctricos. Estos plásticos reciben el nombre de POM (polioximetileno)
Cetonas:
La cetona que mayor aplicación industrial tiene es la acetona (propanona) la cual se utiliza como disolvente para lacas y resinas, aunque su mayor consumo es en la producción del plexiglás, empleándose también en la elaboración de resinas epoxi y poliuretanos. Otras cetonas industriales son la metil etil cetona (MEK, siglas el inglés) y la ciclohexanona que además de utilizarse como disolvente se utiliza en gran medida para la obtención de la caprolactama, que es un monómero en la fabricación del Nylon 6 y también por oxidación del ácido adípico que se emplea para fabricar el Nylon 66.
Muchos aldehídos y cetonas forman parte de los aromas
naturales de flores y frutas, por lo cual se emplean en la perfumería para la
elaboración de aromas como es el caso del benzaldehído (olor de almendras
amargas), el aldehído anísico (esencia de anís), la vainillina, el piperonal
(esencia de sasafrás), el aldehído cinámico (esencia de canela). De origen
animal existe la muscona y la civetona que son utilizados como fijadores porque
evitan la evaporación de los aromas además de potenciarlos por lo cual se
utilizan en la industria de la perfumería.
FUNCIONES EN EL ORGANISMO
Los carbohidratos son aldehídos o cetonas con grupos hidroxilo que pueden existir como cadenas o anillos. Los carbohidratos son las moléculas biológicas más abundantes, y presentan varios papeles en la célula; algunos actúan como moléculas de almacenamiento de energía (almidón y glucógeno) o como componentes estructurales (celulosa en las plantas, quitina en los animales). Los carbohidratos básicos son llamados monosacáridos e incluyen galactosa, fructosa, y el más importante la glucosa. Los monosacáridos pueden sintetizarse y formar polisacáridos.
Los aminoácidos son usados para sintentizar proteínas y otras biomoléculas o bien son oxidados a urea y dióxido de carbono como fuente de energía.Esta ruta oxidativa empieza con la eliminación del grupo amino por una aminotransferasa. El grupo amino es cedido al ciclo de la urea, dejando un esqueleto carbónico en forma de cetoácido. Los aminoácidos glucogénicos pueden ser transformados en glucosa mediante gluconeogénesis.
molecular tienen olores característicos: el cinamaldehído es elresponsable del olor de la canela y el anisaldehído el del anís. Perono todos tienen olores agradables :La butanodiona es uno de loscompuestos responsables del mal olor en la sudoración de pies yaxilas. La metilvinilcetona es un producto comercial utilizado en lafabricación de plásticos.Funciones aldehído y cetonaLos aldehídos se nombran cambiandola terminación –ol del alcohol por –al(etanol etanal); para las cetonas laterminación es –ona. Para cadenassuperiores a 5 átomos de carbonoconsecutivos debe marcarse con unnúmero localizador la función carbonilo.(3-pentanol 3-pentanona) .H3CCH2CH3ObutanonaH3CCH2butanalOHReacti… por excelenciaAl igual que los alcoholes, los compuestos carbonílicospresentan un enlace carbono-oxígeno polarizado, en elque los electrones del doble enlace están parcialmentepolarizados sobre el elemento más electronegativo: eloxígeno. El carbono del grupo carbonilo
ACIDOS CARBOXILICOS
PROPIEDADES DE LOS ÁCIDOS
CARBOXÍLICOS
Los ácidos carboxílicos son compuestos caracterizados por la presencia del grupo carboxilo (-COOH) unido a un grupo alquilo o arilo. Cuando la cadena carbonada presenta un solo grupo carboxilo, los ácidos se llaman monocarboxilicos o ácidos grasos, se les denomina así ya que se obtienen por hidrólisis de las grasas.
El primer miembro de la serie alifática de los ácidos carboxílicos es el ácido metanóico o ácido fórmico, este ácido se encuentra en la naturaleza segregado por las hormigas al morder.
El primer miembro del grupo aromático es el
fenilmetanóico o ácido benzóico. Cuando la cadena carbonada presenta dos grupos
carboxilo, los ácidos se llaman dicarboxílicos, siendo el primer miembro de la
serie alifática el 1, 2 etanodíoco o ácido oxálico.
Propiedades
Físicas:
Solubilidad: El grupo carboxilo –COOH confiere carácter
polar a los ácidos y permite la formación de puentes de hidrógeno entre la
molécula de ácido carboxílico y la molécula de agua. La presencia de dos átomos
de oxígeno en el grupo carboxilo hace posible que dos moléculas de ácido se unan
entre sí por puente de hidrógeno doble, formando un dímero cíclico. Esto hace que los primeros cuatro ácidos monocarboxílicos alifáticos sean líquidos completamente solubles en agua. La solubilidad disminuye a medida que aumenta el número de átomos de carbono. A partir del ácido dodecanóico o ácido láurico los ácidos carboxílicos son sólidos blandos insolubles en agua.
En los ácidos aromáticos monocarboxílicos, la relación carbono-carbono es de 6:1 lo que provoca que la solubilidad se vea disminuida con respecto a los ácidos monocarboxílicos alifáticos.
Punto de ebullición: Los ácidos carboxílicos presentan
puntos de ebullición elevados debido a la presencia de doble puente de
hidrógeno.
Punto de fusión: El punto de fusión varía según el número de carbonos, siendo más elevado el de los ácidos fórmico y acético, al compararlos con los ácidos propiónico, butírico y valérico de 3, 4 y 5 carbonos, respectivamente. Después de 6 carbonos el punto de fusión se eleva de manera irregular.
Esto se debe a que el aumento del número de átomos de carbono interfiere en la asociación entre las moléculas. Los ácidos monocarboxílicos aromáticos son sólidos cristalinos con puntos de fusión altos respecto a los ácidos alifáticos.
Los ácidos fórmico y acético (1, 2 carbonos) son líquidos de olores irritantes. Los ácidos butíricos, valeriano y capróico (4, 5 y 6 carbonos) presentan olores desagradables. Los ácidos con mayor cantidad de carbonos presentan poco olor.
Nombre Pto. de fusión ºC Pto. de ebullición ºC Solubilidad gr en 100 gr de agua.
Ac. metanóico 8 100,5 Muy soluble
Ac. etanóico 16,6 118 Muy soluble
Ac. propanóico -22 141 Muy soluble
Ac. butanóico -6 164 Muy soluble
Ac. etanodióico 189 239 0,7
Ac. propanodióico 135,6 Soluble
Ac. fenilmetanóico 122 Soluble
Ac. ftálico 231 250 O,34
Propiedades Químicas:
Constantes de acidez de algunos ácidos carboxílicos
Ácidos alifáticos Ka Ácidos aromáticos Ka
Métanoico 17,7 x 10-5 Fenil-metanóico 6,3 x 10-5
Etanóico 1,75 x 10-5 Paranitrobenzóico 36 x 10-5
Propanóico 1,3 x 10-5 Metanitrobenzoico 32 x 10-5
2-metilbutanoico 1,68 x 10-5 Ortonitrobenzóico 670 x 10-5
REACCIONES PARA LA OBTENCIÓN DE LOS ÁCIDOS
CARBOXÍLICOS
Los ácidos carboxílicos pueden obtenerse a partir de reacciones químicas como la oxidación de alcoholes primarios, de los compuestos alquil-bencénicos y por la hidrólisis de nitrilos entre otras.
Oxidación de alcoholes primarios: para obtener ácidos carboxílicos mediante esta reacción, el alcohol primario se trata con un agente oxidante fuerte donde el alcohol actúa como un agente reductor oxidándose hasta ácido carboxílico.
Oxidación de los
compuestos alquil-bencénicos: la oxidación de los derivados alquil-bencénicos
con mezclas oxidantes fuertes llevan a la formación de ácidos carboxílicos.
Hidrólisis de
Nitrilos: los nitrilos se hidrolizan al ser sometidos a ebullición con ácidos
minerales o álcalis en solución acuosa, generando ácidos carboxílicos mediante
sustitución nucleofílica.
Derivados de los Ácidos Carboxílicos: Los derivados carboxílicos son compuestos que presentan el grupo acilo o el grupo aroilo en los ácidos alifáticos o aromáticos.
Entre los derivados de los ácidos carboxílicos se encuentran: las sales de ácido, los ésteres, los haluros de ácidos, anhídridos de ácidos, amidas e imidas.
Propiedades físicas de los derivados de ácidos
carboxílicos:
Los ésteres no presentan puentes de hidrógeno intermolecular por lo que sus puntos de ebullición son similares a los de los alcanos de pero molecular similar. A partir de los tres átomos de carbono, su solubilidad en agua disminuye. Se disuelven bien en solventes orgánicos. Los más volátiles tienen olores agradables. Se usan en perfumería y para preparar condimientos artificiales.
Haluros de ácido: La mayor importancia la tienen los
cloruros de ácido. El primer miembro de la serie alifática es el cloruro de
metanoilo o cloruro de formilo, el cual es un compuesto inestable.
La mayoría son líquidos de bajo punto de fusión y olores irritantes. No presentan puente de hidrógeno intermolecular, por lo que sus puntos de ebullición son más bajos que los de los ácidos de los que se derivan.
nhídridos de ácido: En este grupo sólo tiene importancia el anhídrido etanóico, que es un compuesto polar, no presenta puente de hidrógeno intermolecular por ser el producto de la deshidratación de dos moles de ácido carboxílico. Sus puntos de ebullición son similares a los de los aldehídos y cetonas de peso molecular semejante.
El primer miembro de la serie alifática es la metanamida o formamida que es diluida a temperatura ambiente, el resto de las amidas son sólidas. Presentan un puente de hidrógeno intermolecular por lo que sus puntos de ebullición son altos.
Son compuestos polares, lo cual junto con la formación
de puente de hidrógeno con el agua las hace solubles en esta. La solubilidad
disminuye a partir de los cinco carbonos, debido a que la relación carbono –
amino es mayor que 3:1. La etanamida y sus homólogos son excelentes solventes
orgánicos.
FUNCIONES EN EL
ORGANISMO
Producción
de Energía. En un estudio con atletas en Dinamarca, demostramos
que luego de un mes de darles una cucharada par cada 50 libras de peso por día
de una mezcla de aceites con una relación de omega 3:omega6 de 2:1, su
resistencia aumentó en un 40 y hasta un 60%. Los atletas pudieron ejercitar por
más tiempo antes de agotarse, se recobraron más rápidamente de la fatiga,
pudieron ejercitar más seguido sin entrenamiento extra, sus lesiones sanaron más
rápido, desarrollaron musculatura con más velocidad y tuvieron menos dolores
articulares.
El aumento de la energía también se puede ver en no atletas y en personas mayores. La mezcla de AGEs también mejora la resistencia mental.
El aumento de la energía también se puede ver en no atletas y en personas mayores. La mezcla de AGEs también mejora la resistencia mental.
Función Cerebral. Durante nuestro trabajo con la mezcla de aceites, hemos visto consistentes mejoras en la función cerebral, e investigaciones con AGEs de otras fuentes también han demostrado beneficios para el cerebro. Entre ellas, se incluyen mejoría en el ánimo, reducción de la depresión, aumento de la calma, mejor manejo del estrés, menos hiperactividad, mejor focalización, mejora en los procesos mentales, aceleración en el aprendizaje, aumento de inteligencia, mayor concentración y mejora en la coordinación motriz.
Entre los enfermos mentales, los AGEs pueden disminuir las alucinaciones en esquizofrénicos, elevar el ánimo, reducir la depresión, aliviar los síntomas en desórdenes bipolares y obsesivo-compulsivos, y mejorar la función cerebral en la enfermedad de Alzheimer y el autismo.
Los AGEs son también necesarios para la visión.
Piel,
Cabello y Uñas.
Los AGEs son necesarios para tener piel y cabello saludables, así como para el
crecimiento normal de las uñas. Humedecen la piel y evitan la
sequedad.
Cáncer.Los AGEs omega 3 reducen los riesgos de cáncer.
Enfermedad Cardiovascular (ECV). Los omega 3 pueden reducir la mayoría de los factores de riesgo de las ECV, incluyendo los triglicéridos altos (grasas de la sangre), la presión sanguínea, la adhesividad plaquetaria, el fibrinógeno, y la lipoproteína (a). Los omega 3 también mantienen liso el interior de nuestras arterias. Los omega 3 y los omega 6 regularizan el ritmo cardíaco.
Diabetes.
Los AGEs son necesarios para el funcionamiento de la insulina. Los omega 3 hacen
que los diabéticos se vuelvan más sensibles a la
insulina.
Control
del Peso.
Los omega 6, ligeramente, y los omega3 de manera más efectiva, ayudan a reducir
la producción de grasa en el cuerpo. También aumentan el proceso de quema de
grasa y la producción de calor en el cuerpo, y hacen que el cuerpo pase de
quemar glucosa a quemar grasa. Los ácidos grasos saturados, mono-saturados y
trans no ayudan a controlar el peso. El azúcar provoca un aumento en la
producción de grasa en el cuerpo. El almidón también puede provocar
sobrepeso.
Digestión.
Los AGEs mejoran la integridad intestinal, reducen la inflamación intestinal y
reducen la posibilidad de intestinos porosos, que pueden conducir a
alergias.
Alergias.
Los AGEs reducen los síntomas de las alergias. Trabajan mejor si se utilizan
también enzimas digestivas ricas en proteasas
proteínico-digestivas.
Inflamación.
Los omega 3 reducen la inflamación. Las enzimas digestivas también
ayudan.
Enfermedades
Auto-inmunes.
Los omega 3 inhiben la sobre-respuesta del sistema inmunológicen enfermedades
auto-inmunes. En este caso también son útiles las
enzimas.
Heridas.
Los AGEs aceleran la sanación de heridas.
Minerales
Óseos.
Los omega 3 mejoran la retención de minerales en los huesos inhibiendo, de esta
manera, el desarrollo de osteoporosis.
Estrés.
A través de la optimización de la producción de serotonina, los AGEs mejoran las
reacciones frente al estrés. La gente afirma sentirse más calma, no estresarse
con tanta facilidad, manejar situaciones estresantes de manera más tranquila y
perder el control menos frecuentemente.
Sueño.
Los AGEs mejoran la calidad del sueño en algunas personas.
Hormonas.
Los AGEs mejoran las funciones hormonales. El nivel hormonal puede disminuir,
pero los efectos hormonales se mantienen normales. Los AGEs, por lo tanto,
reducen el trabajo de las glándulas.Órganos. Los AGEs son necesarios para
el funcionamiento del hígado y el riñón.
Reproducción.
Los AGEs son necesarios para la formación de esperma, el ciclo femenino y el
embarazo.
AFECTACIÓN EN EL ORGANISMO DEL EXESO Y LA CARENCIA DE
ESE COMPUETOS
Estos
compuestos son esenciales porque nuestro
organismo no los produce y su carencia está involucrada en un sin fín de
enfermedades. Se encuentran principalmente en los aceites, pero sólo si han sido
extraídos por presión en frío. Como empiezas a sospechar, un porcentaje altísimo
de la población del mundo occidental no los incluye en su dieta porque usa
aceites y cereales refinados en su alimentación diaria. Aprende en este artículo
qué son, cómo asegurar su presencia en tu dieta diaria y cuáles son algunas de
las opciones disponibles en el mercado.
Reumatismos, alergias, várices, hemorroides, fibromas,
pólipos, hipertensión, eccema, caída del cabello, infecciones frecuentes, mala
cicatrización, pérdida de visión, edema, piel seca son sólo algunas de las
enfermedades relacionadas con la carencia o insuficiencia de ácidos grasos
esenciales. Según algunos estudiosos, la incidencia de enfermedades
degenerativas creció después de la Segunda Guerra Mundial, cuando se comenzó a
extraer los aceites en caliente -a temperaturas que oscilan en los 200ºC-,
duplicando el rendimiento, pero deteriorando la calidad nutricional de los
aceites, hasta convertirlos en un factor de riesgo para la salud.
Se trata de aceites muertos porque el tratamiento industrial de los mismos modifica sus propiedades. Especialmente el proceso de "hidrogenación" al que son expuestos, produce una modificación en la configuración espacial de parte de sus moléculas, haciendo que luego no puedan integrarse en nuestras cadenas metabólicas: algo así como una pieza que no acaba de encajar en el rompecabezas. Lo que no se metaboliza adecuadamente produce en nuestro organismo por un lado, una sobrecarga de toxinas y por otro, en el caso de los aceites refinados, una falta de ácidos grasos esenciales.
A los ácidos grasos esenciales o poliinsaturados
también se los conoce como Vitamina F. Son cinco: ácido linoleico, ácidos
alfalinolénico, ácido gammalinolénico, ácido dihomogammalinolénico y ácido
araquidónico, y se los considera "esenciales" porque nuestro organismo no los
fabrica, a pesar de ser sustancias involucradas en funciones vitales para el ser
humano, especialmente:
en la estructura de las membranas celulares en la síntesis de prostaglandinas, lecitina y mielina.
ÉTERES
Los
éteres están comprendidos como
una clase de compuestos en los cuales dos grupos del tipo de los hidrocarburos
están enlazados a un átomo de oxígeno,
es decir su estructura general es del tipo R-O-R. En los éteres simétricos los dos grupos son
idénticos mientras que en los asimétricos son
diferentes.
Nomenclatura de los
éteres.
Los ejemplos que siguen ilustran los nombres comunes de
algunos éteres.La nomenclatura IUPAC (International Union of Pure and Applied Chemistry) establece que para llamar a los éteres se comience por numerar el carbono que tiene el grupo alcoxilo (RO-) o el aroxilo (ArO-) , seguido por el nombre correspondiente al alcano formado por la cadena mas larga de carbonos acoplada al oxígeno y utilizando para esta último la misma nomenclatura de los alcanos.
Los ejemplos que siguen ilustran lo explicado.
Fuentes naturales y usos de los éteres.
El éter etílico (o simplemente éter), se obtiene sintéticamente, y es un depresor del sistema nervioso central, por este motivo ha sido utilizado como anestésico.
Probablemente el éter sea la sustancia mas utilizada en el laboratorio para los procesos de extracción con solvente, aun siendo potencialmente peligroso por su inflamabilidad y volatilidad.
PROPIEDADES FÍSICAS DE LOS
ÉTERES.
El
éter metílico (P.e. -24°C) y el éter metil etílico (P.e. 8°C) son gases a
temperatura normal. Ya el éter etílico (P.e. 35°C) es un líquido muy volátil.
Los éteres con cadenas carbonadas mayores van teniendo mayor punto de ebullición
a medida que aumenta la longitud de la cadena.
Los éteres de cadena recta tiene un punto de ebullición bastante similar a los alcanos con peso molecular comparable. Por ejemplo: el éter C2-H5-O-C2-H5, con peso molecular 74 tiene un punto de ebullición de 35°C, y el alcano CH3-CH2-CH2-CH2-CH3 de peso molecular 72 tiene un punto de ebullición de 36°C.
Los éteres tienen una solubilidad en agua comparable con los alcoholes para peso molecular similar, así el éter C2-H5-O-C2-H5 tiene la misma solubilidad que el alcohol CH3-CH2-CH2-CH2-OH unos 8g/100ml de agua a 25°C.
Los éteres de cadena recta tiene un punto de ebullición bastante similar a los alcanos con peso molecular comparable. Por ejemplo: el éter C2-H5-O-C2-H5, con peso molecular 74 tiene un punto de ebullición de 35°C, y el alcano CH3-CH2-CH2-CH2-CH3 de peso molecular 72 tiene un punto de ebullición de 36°C.
Los éteres tienen una solubilidad en agua comparable con los alcoholes para peso molecular similar, así el éter C2-H5-O-C2-H5 tiene la misma solubilidad que el alcohol CH3-CH2-CH2-CH2-OH unos 8g/100ml de agua a 25°C.
PROPIEDADES QUÍMICAS DE LOS
ÉTERES.
Los éteres son muy inertes químicamente y solo tiene unas pocas reacciones características.
Reacción con los haluros de
hidrógeno.
Los
haluros de hidrógeno (cuyas reactividades están en el orden HI>HBr>HCl)
son capaces de romper los enlaces del oxígeno del éter y formar dos moléculas
independientes. Los éteres alifáticos
se rompen en dos moléculas del haluro de alquilo correspondiente, mientras que
en los éteres alquilo arilo se forman el alquil haluro correspondiente y
fenol. Las reacciones que siguen con el HI sirven para
ilustrar.
R-O-R' + HI -------------------->
R-I + R'-I + H2O
Ar-O-R + HI --------------> Ar-OH + R-I
Ar-O-R + HI --------------> Ar-OH + R-I
Reacción con el oxígeno del
aire.
Cuando los éteres están en contacto con el aire,
espontánea y lentamente se produce su oxidación que genera un peróxido derivado
muy inestable.
La presencia de estos peróxidos son un elevado peligro potencial cuando el éter se somete a un proceso de destilación. En este caso, los peróxidos en el líquido no destilado aun, se van concentrando y pueden producir una violenta explosión.
Una regla de seguridad básica para hacer destilados con éteres es asegurarse de que en él no hayan peróxidos, y en caso de haberlos, eliminarlos antes de la destilación.
La presencia de estos peróxidos son un elevado peligro potencial cuando el éter se somete a un proceso de destilación. En este caso, los peróxidos en el líquido no destilado aun, se van concentrando y pueden producir una violenta explosión.
Una regla de seguridad básica para hacer destilados con éteres es asegurarse de que en él no hayan peróxidos, y en caso de haberlos, eliminarlos antes de la destilación.
REACCIONES PARA LA OBTENCIÓN DE ÉTERES
Los éteres pueden obtenerse por deshidratación de los alcoholes con ácido sulfúrico o también con ácido fosfórico glacial:
CH3-CH2OH+CH3-CH2OH à C2H5-O-C2H5+H2O
SO4H2
También se preparan calentando un alcóxido alcalino con los halogenuros de alquilo:
RONa+R´X à R-C-R´+Xna (R es cualquier grupo: etil, metil, fenil y X es cualquier halogeno: cloro, yodo, bromo
FUNCIONES EN EL
ORGANISMO
Cuando analizamos el ser
humano, encontramos en él los cuatro éteres: químico, de vida, luminoso y
reflector. Estos cuatro éteres se encuentran en el hombre en forma diferente y
activa, en su bien desarrollado cuerpo vital. Mediante la actividad del éter
químico, se encuentra en condiciones de asimilar el alimento y crecer; las
fuerzas del éter de vida le permiten propagar su especie; las energías del éter
luminoso proporcionan el calor del cuerpo, a la vez que operan en los nervios y
músculos, abriendo así las puertas de comunicación con el mundo exterior, por
medio de los sentidos. Y el éter reflector finalmente permite que el espíritu
controle sus vehículos mediante el pensamiento. Este éter es el que almacena las
experiencias pasadas, en forma de memoria. Los
éteres químico y de vida constituyen la matriz de nuestros cuerpos físicos. Cada
molécula del cuerpo físico está como sumergida en una red de éter que lo
impregna y lo llena de vida. Merced a estos éteres se llevan a cabo las
funciones corporales de la respiración, etc., y de la densidad y consistencia de
estas matrices etéricas depende el estado de salud. Los
átomos de los éteres químicos y de vida reunidos en torno de la simiente atómica
nucleoar, en el Plexo Solar, tienen una forma prismática. Están todos situados
en tal forma que cuando la energía solar entra en el cuerpo por el bazo, el rayo
que se refracta es el rojo. Éste es el color del aspecto del creador de la
Trinidad, o sea Yejovâ (Jehová), el Espíritu Santo, regido por la Luna, el
planeta de la fecundación. Por consiguiente, los fluidos vitales del Sol, que
penetran en el cuerpo humano por el bazo se tiñen con un ligero color de rosa,
que muchas veces pueden observar los videntes circulando por los nervios, como
sí fuera electricidad pasando por los alambre de una instalación eléctrica. Así
cargados, los éteres químico y de vida son las vías de asimilación que preservan
al individuo, y de fecundación, que perpetúan la raza.
Durante la vida, cada átomo prismático vital compenetra un átomo físico y lo hace vibrar. Para hacerse una idea de esta combinación, podemos imaginarnos una canasta de alambre curvado espiralmente, que fuera de un polo al otro. Éste es el átomo físico, el que está formado de manera muy parecida al de nuestra Tierra, y el átomo prismático vital queda insertado desde arriba, que es el punto más ancho y que correspondería al polo norte de
nuestra Tierra. Así pues, la punta del prisma penetra en el átomo físico en el punto más estrecho, que corresponde al polo sur de la Tierra, y todo el conjunto se parece a un trompo que gira y bambolea a la vez que vibra intensamente. Así es como nuestro cuerpo se llena de vida y es capaz de moverse.
Los éteres luminoso y reflector son los conductores de la conciencia y de la memoria. En el individuo corriente se encuentran un tanto atenuados y no han tomado todavía una forma definida. Ínter penetran el átomo en 1a misma forma en que el aire ínter penetra una esponja y forma algo así como una ligera atmósfera áurica por fuera de cada átomo.
Ya ha quedado demostrado por la ciencia material que los átomos de nuestro cuerpo denso están cambiando constantemente, de tal manera que toda la materia que compone actualmente nuestro vehículo habrá desaparecido en unos pocos años, a pesar de lo cual las cicatrices y otras manchas siguen conservándose desde la niñez hasta la ancianidad. La razón de este fenómeno reside en que los átomos prismáticos que componen nuestro cuerpo vital hermanen sin cambio alguno desde la cuna hasta la tumba. Siempre se encuentran en las mismas posiciones relativas; esto es, los átomos etéricos prismáticos que hacen vibrar a los átomos físicos de los dedos de los pies o de las manos, no cambian de situación y se van a otras partes del cuerpo, sino que permanecen exactamente en el mismo lugar en que fueron colocados al principio. Una lesión en los átomos físicos implica una impresión similar en átomos etéricos prismáticos. La nueva sustancia física que se modela sobre ellos continúa entonces tomando la forma y la contextura similares a los que tenía originalmente.
Estas observaciones se aplican exclusivamente a los átomos prismáticos que corresponden a los sólidos y los líquidos en el Mundo Físico, porque asumen cierta forma definida que conservan. Pero, además, en la actual etapa de la Evolución, cada ser humano tiene cierta cantidad de éteres luminoso y reflector, que son los vehículos de la percepción sensorial y de la memoria, entremezclados en su cuerpo vital. Podríamos decir que el éter luminoso corresponde a los gases del Mundo Físico, y la mejor descripción que podríamos dar del éter reflector es la de llamarlo hiperetérico. Es una sustancia vacua, de color azulado, que se parece por su color al centro azulado de una llama de gas. Aunque se presenta como si fuera transparente y pareciera revelar todas las cosas, en realidad oculta todos los secretos de a Naturaleza y de la Humanidad. Los éteres luminosos y reflector son de naturaleza exactamente opuesta a la de los átomos etéricos prismáticos y estacionarios. Son volátiles y migrato-rios. Sea cual fuere la cantidad que el ser humano posea de estas substancias, siempre son la fructificación o cosecha de las experiencias de su vida. Dentro del cuerpo se mezclan con la sangre, y cuando han ido creciendo merced al servicio y al sacrificio que se hace en la escuela de la vida, de manera que ya no puedan quedar contenidos dentro del cuerpo, se los puede observar fuera de este como un cuerpo anímico coloreado de oro y azul.
El azul es lo que muestra el tipo más elevado de espiritualidad, por cuyo motivo suele ser el más pequeño en volumen y puede comparare al corazón azul de la llama del gas. El color dorado forma la parte mayor y correspondería a la parte de luz amarilla que rodea al centro azul de la citada llama de gas. El color azul no aparece fuera del cuerpo más que en las personas de extraordinaria santidad y solo se observa generalmente el color amarillo.
Durante la vida, cada átomo prismático vital compenetra un átomo físico y lo hace vibrar. Para hacerse una idea de esta combinación, podemos imaginarnos una canasta de alambre curvado espiralmente, que fuera de un polo al otro. Éste es el átomo físico, el que está formado de manera muy parecida al de nuestra Tierra, y el átomo prismático vital queda insertado desde arriba, que es el punto más ancho y que correspondería al polo norte de
nuestra Tierra. Así pues, la punta del prisma penetra en el átomo físico en el punto más estrecho, que corresponde al polo sur de la Tierra, y todo el conjunto se parece a un trompo que gira y bambolea a la vez que vibra intensamente. Así es como nuestro cuerpo se llena de vida y es capaz de moverse.
Los éteres luminoso y reflector son los conductores de la conciencia y de la memoria. En el individuo corriente se encuentran un tanto atenuados y no han tomado todavía una forma definida. Ínter penetran el átomo en 1a misma forma en que el aire ínter penetra una esponja y forma algo así como una ligera atmósfera áurica por fuera de cada átomo.
Ya ha quedado demostrado por la ciencia material que los átomos de nuestro cuerpo denso están cambiando constantemente, de tal manera que toda la materia que compone actualmente nuestro vehículo habrá desaparecido en unos pocos años, a pesar de lo cual las cicatrices y otras manchas siguen conservándose desde la niñez hasta la ancianidad. La razón de este fenómeno reside en que los átomos prismáticos que componen nuestro cuerpo vital hermanen sin cambio alguno desde la cuna hasta la tumba. Siempre se encuentran en las mismas posiciones relativas; esto es, los átomos etéricos prismáticos que hacen vibrar a los átomos físicos de los dedos de los pies o de las manos, no cambian de situación y se van a otras partes del cuerpo, sino que permanecen exactamente en el mismo lugar en que fueron colocados al principio. Una lesión en los átomos físicos implica una impresión similar en átomos etéricos prismáticos. La nueva sustancia física que se modela sobre ellos continúa entonces tomando la forma y la contextura similares a los que tenía originalmente.
Estas observaciones se aplican exclusivamente a los átomos prismáticos que corresponden a los sólidos y los líquidos en el Mundo Físico, porque asumen cierta forma definida que conservan. Pero, además, en la actual etapa de la Evolución, cada ser humano tiene cierta cantidad de éteres luminoso y reflector, que son los vehículos de la percepción sensorial y de la memoria, entremezclados en su cuerpo vital. Podríamos decir que el éter luminoso corresponde a los gases del Mundo Físico, y la mejor descripción que podríamos dar del éter reflector es la de llamarlo hiperetérico. Es una sustancia vacua, de color azulado, que se parece por su color al centro azulado de una llama de gas. Aunque se presenta como si fuera transparente y pareciera revelar todas las cosas, en realidad oculta todos los secretos de a Naturaleza y de la Humanidad. Los éteres luminosos y reflector son de naturaleza exactamente opuesta a la de los átomos etéricos prismáticos y estacionarios. Son volátiles y migrato-rios. Sea cual fuere la cantidad que el ser humano posea de estas substancias, siempre son la fructificación o cosecha de las experiencias de su vida. Dentro del cuerpo se mezclan con la sangre, y cuando han ido creciendo merced al servicio y al sacrificio que se hace en la escuela de la vida, de manera que ya no puedan quedar contenidos dentro del cuerpo, se los puede observar fuera de este como un cuerpo anímico coloreado de oro y azul.
El azul es lo que muestra el tipo más elevado de espiritualidad, por cuyo motivo suele ser el más pequeño en volumen y puede comparare al corazón azul de la llama del gas. El color dorado forma la parte mayor y correspondería a la parte de luz amarilla que rodea al centro azul de la citada llama de gas. El color azul no aparece fuera del cuerpo más que en las personas de extraordinaria santidad y solo se observa generalmente el color amarillo.
ÉSTERES
Los ésteres se forman por reacción entre un ácido y un alcohol. La reacción se produce con pérdida de agua. Se ha determinado que el agua se forma a partir del OH del ácido y el H del alcohol. Este proceso se llama esterificación.
Pueden provenir de ácidos alifáticos o aromáticos.
Se nombran como sales, reemplazando la terminación de los ácidos por tanto seguido del nombre del radical del alcohol.
Ejemplo: etanoato de propilo es un éster formado a partir del ácido etanoico y el alcohol propílico.Propiedades físicas
Propiedades químicas
Hidrólisis ácida:Por calentamiento con agua se descompone en el alcohol y el ácido de los que proviene.
éster + agua ------------- ácido + alcohol
Con un exceso de agua la reacción es total. Es un proceso inverso a la esterificación.
CH3.CO.O.CH3 + H2O ------------ CH3.CO.OH + H.CH2.OHHidrólisis alcalina - SaponificaciónEn presencia de un hidróxido y con exceso de agua y calor, se produce una reacción que da como productos el alcohol y la sal del ácido del que proviene. Esta sal es el jabón lo que da el nombre a la reacción.
éster + hidróxido -------------- sal de ácido + alcohol.Usos
Formiato de etilo: esencia de grosella, ron
Acetato de etilo: esencia de manzana y pera. Solvente de la nitrocelulosa.
Butirato de etilo: esencia de durazno.
Acetato de butilo: solvente de la nitrocelulosa. Lacas; barnices; plásticos; vidrios de seguridad; perfumes.
Acetato de amilo: solvente de lacas y barnices
Hidrólisis ácida:Por calentamiento con agua se descompone en el alcohol y el ácido de los que proviene.
éster + agua ------------- ácido + alcohol
Con un exceso de agua la reacción es total. Es un proceso inverso a la esterificación.
CH3.CO.O.CH3 + H2O ------------ CH3.CO.OH + H.CH2.OHHidrólisis alcalina - SaponificaciónEn presencia de un hidróxido y con exceso de agua y calor, se produce una reacción que da como productos el alcohol y la sal del ácido del que proviene. Esta sal es el jabón lo que da el nombre a la reacción.
éster + hidróxido -------------- sal de ácido + alcohol.Usos
Formiato de etilo: esencia de grosella, ron
Acetato de etilo: esencia de manzana y pera. Solvente de la nitrocelulosa.
Butirato de etilo: esencia de durazno.
Acetato de butilo: solvente de la nitrocelulosa. Lacas; barnices; plásticos; vidrios de seguridad; perfumes.
Acetato de amilo: solvente de lacas y barnices
Reacciones para lo formación de un eter
los ésteres se preparan por reacción de los yoduros de alquilo con sales de plata:
CH3-COOAg+ICH3à CH3-COOCH3+Iag (aqui I es yodo)
Por la acción de un cloruro de ácido sobre un alcohol.
CH3-COCl+NaOC2H5 à CH3-COOC2H5+ClNa (aqui Cl es cloro)
http://quimicaparatodos.blogcindario.com/2009/09/00077-los-esteres.html
AMINAS
Propiedades de las
Aminas
Las aminas son
compuestos orgánicos derivados del amoniaco (NH3), y son producto de la
sustitución de los hidrógenos que componen al amoniaco por grupos alquilo o
arilo.
Las aminas se clasifican de acuerdo al número de
sustituyentes unidos al nitrógeno en aminas primarias, aminas secundarias y
terciarias.
Propiedades físicas
El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida
(p.f.=2.5 ºC), sean todas sólidas y solubles en agua. Sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes, debido a una gran asociación intermolecular a través de enlaces de hidrógeno, entre el oxígeno negativo y los enlaces N—H, mucho más polarizados que en las aminas. Los puntos de fusión y de ebullición de las amidas secundarias son bastante menores, debido principalmente al impedimento estérico del radical unido al nitrógeno para la asociación. Como es natural, las amidas terciarias (sin enlaces N—H) no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y de ebullición de acuerdo con su peso molecular.
Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite que se encuentren como compuestos coloreados. Los primeros miembros de esta serie son gases con olor similar al amoníaco. A medida que aumenta el número de átomos de carbono en la molécula, el olor se hace similar al del pescado. Las aminas aromáticas son muy tóxicas se absorben a través de la piel.
Amina secundaria aromática
Solubilidad: Las aminas primarias y secundarias son
compuestos polares, capaces de formar puentes de hidrógeno entre sí y con el
agua, esto las hace solubles en ella. La solubilidad disminuye en las moléculas
con más de 6 átomos de carbono y en las que poseen el anillo aromático.
Punto de Ebullición: El punto de ebullición de las
aminas es más alto que el de los compuestos apolares que presentan el mismo peso
molecular de las aminas. El nitrógeno es menos electronegativo que el oxígeno,
esto hace que los puentes de hidrógeno entre las aminas se den en menor grado
que en los alcoholes. Esto hace que el punto de ebullición de las aminas sea más
bajo que el de los alcoholes del mismo peso
molecular.
(Constantes físicas de algunas Aminas)
Nombre Pto. de fusión(ºC) Pto. de ebullición(ºC) Solubilidad (gr/100 gr de H2O)
Metil-amina
-92 -7,5 Muy soluble
Dimetil-amina -96 7,5 Muy soluble
Trimetil-amina -117 3 91
Fenil-amina -6 184 3,7
Difenil-amina 53 302 Insoluble
Metilfenil-amina -57 196 Muy poco soluble
Síntesis de aminas: Las aminas se obtienen tratando
derivados halogenados o alcoholes con amoniaco.
reacciones de obtención
Las amidas pueden obtenerse a partir de halogenuros de alquilo por reacción con amoniaco, aminas primarias o secundarias, con lo que resultan amidas primarias, secundarias o terciarias, respectivamente. Por ejemplo:
CH3—CO—Cl + 2 CH3—NH2 CH3—CO—NH—CH3 + CH3—NH3+ Cl-
cloruro de acetilo metilamina N-metilacetamida cloruro de metilamonio
Reacciones
Las reacciones químicas de las amidas son las generales de los derivados funcionales de ácidos carboxílicos, si bien son entre éstos, de los compuestos menos reactivos. Así, por ejemplo, la reacción de hidrólisis suele ser muy lenta, por lo que hay que llevarla a cabo calentando y en medios ácidos o básicos; su mecanismo es análogo al de la hidrólisis de los ésteres.
Por otra parte, las amidas tienen también algunas reacciones químicas parecidas a las de las aminas, siendo la más análoga la reacción con ácido nitroso, con el que los tres tipos de amidas se comportan igual que las aminas.
Entre las amidas merece citarse la carbodiamida o urea, que puede considerarse como la diamida del ácido carbónico:
H2N—O—NH2
urea
Es el producto de excreción nitrogenado más importante, tanto en el hombre como en los animales. Por otra parte, tiene también un gran interés técnico, por su utilización como abono, así como en la industria farmacéutica, y sobre todo para la fabricación de resinas y materiales plásticos.
Las amidas pueden obtenerse a partir de halogenuros de alquilo por reacción con amoniaco, aminas primarias o secundarias, con lo que resultan amidas primarias, secundarias o terciarias, respectivamente. Por ejemplo:
CH3—CO—Cl + 2 CH3—NH2 CH3—CO—NH—CH3 + CH3—NH3+ Cl-
cloruro de acetilo metilamina N-metilacetamida cloruro de metilamonio
Reacciones
Las reacciones químicas de las amidas son las generales de los derivados funcionales de ácidos carboxílicos, si bien son entre éstos, de los compuestos menos reactivos. Así, por ejemplo, la reacción de hidrólisis suele ser muy lenta, por lo que hay que llevarla a cabo calentando y en medios ácidos o básicos; su mecanismo es análogo al de la hidrólisis de los ésteres.
Por otra parte, las amidas tienen también algunas reacciones químicas parecidas a las de las aminas, siendo la más análoga la reacción con ácido nitroso, con el que los tres tipos de amidas se comportan igual que las aminas.
Entre las amidas merece citarse la carbodiamida o urea, que puede considerarse como la diamida del ácido carbónico:
H2N—O—NH2
urea
Es el producto de excreción nitrogenado más importante, tanto en el hombre como en los animales. Por otra parte, tiene también un gran interés técnico, por su utilización como abono, así como en la industria farmacéutica, y sobre todo para la fabricación de resinas y materiales plásticos.
Amina primaria
Amina primaria aromática
Amina secundaria
Producción de aminas a partir de derivados halogenados
Las aminas inferiores se preparan comercialmente haciendo pasar amoniaco y vapores de alcohol en presencia de óxido de thorio o de aluminio caliente.
La reducción de diversos compuestos como
nitroderivados, nitrilaldehídos o cetonas también tiene entre sus productos
finales las aminas.
Reacciones para reconocer aminas en el laboratorio.
Para diferenciar las aminas entre sí en el laboratorio se hacen reaccionar con una solución de nitrito de sodio y ácido clorhídrico, esto da origen a ácido nitroso inestable. Cada tipo de amina tendrá un comportamiento diferente frente al ácido nitroso, dependiendo además de la temperatura a la cual se lleve a cabo la reacción.
En cuanto a las aminas primarias: las aminas alifáticas (link con Nomenclatura Orgánica cuarta etapa) reaccionan con el ácido nitroso para dar un alcohol con desprendimiento de nitrógeno y agua.
Las aminas aromáticas al reaccionar con ácido nitroso a
temperatura elevada en presencia de ácido sulfúrico diluido se comportan como
las aminas alifáticas, pero si la reacción ocurre a 0ºC se produce una sal de
diazonio soluble en agua.
Las aminas secundarias tanto alifáticas como aromáticas al reaccionar con el ácido nitroso generan N-nitrosaminas oleosas e insolubles en agua, llamadas también compuestos N-nitrosos.
En cuanto a las aminas terciarias tanto alifáticas como aromáticas al reaccionar con el ácido nitroso generan derivados N-nitrosados y productos complejos respectivamente que son motivo de estudio.
Aminas. ¿Dónde se encuentran?
Las aminas se encuentran formando parte de la naturaleza, en los aminoácidos que conforman las proteínas que son un componente esencial del organismo de los seres vivos. Al degradarse las proteínas se descomponen en distintas aminas, como cadaverina y putrescina entre otras. Las cuales emiten olor desagradable. Es por ello que cuando la carne de aves, pescado y res no es preservada mediante refrigeración, los microorganismos que se encuentran en ella degradan las proteínas en aminas y se produce un olor desagradable.
Las aminas son parte de los alcaloides que son compuestos complejos que se encuentran en las plantas. Algunos de ellos son la morfina y la nicotina. Algunas aminas son biológicamente importantes como la adrenalina y la noradrenalina.
Las aminas secundarias que se encuentran en las carnes y los peso en el humo del tabaco.
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedaes_aminas.htm
FUNCIONES EN EL
ORGANISMO
Las aminas hacen parte del organismo de los seres vivos, están presentes en los aminoácidos que componen las proteínas, en los ácidos ribonucleicos (ADN y ARN), las hormonas y las vitainas, además son muy utilizadas en la medicina.
Las aminas cumplen la función de catalizadores metabólicos en la síntesis de hormonas, ácidos nucleicos, proteínas y la duplicación del ADN, Algunas aminas sirven para el buen funcionamiento del intestino, mientras otras aminas se encargan del funcionamiento del sistema nervioso y del control de la presión sanguínea.
Las aminas más importantes biológicamente son las que pertenecen al grupo de las β-feniletilaminas, como la adrelina, la noradrelina, la mescalina, entre otros. Las catecolaminas son un grupo de aminas en las que se inluye la adrenalina, la noradrenalina y la dopamina, y son producidas en las glándulas suprerrenales, debido a que ejercen funciones hormonales, o también pueden estar en las terminaciones nerviosas, por lo que se consideran neurotransmisores.
Las aminas secundarias se encuentran en las carnes y los pescados o en el humo del tabaco. En general las aminas se encuentran en las proteínas presentes en la naturaleza.



No hay comentarios:
Publicar un comentario